NCERT Solutions for Class 12 Chemistry Chapter 8 The d and f Block Elements in Hindi (d-एवं f-ब्लॉक के तत्त्व)
Very Important Question class 12 chemistry The d and f Block Elements in Hindi
एनसीईआरटी कक्षा 12 रसायन शास्त्र अध्याय 8 : d-एवं f-ब्लॉक के तत्त्व समाधान हिंदी में: क्या आप कक्षा 12 के रसायन शास्त्र के एनसीईआरटी समाधान हिंदी में खोज रहे हैं, यदि हाँ तो आप सही जगह पर आए हैं? हमारे विशेषज्ञ ने सभी विषयों के लिए एनसीईआरटी कक्षा 12 के समाधान बहुत ही वर्णनात्मक तरीके से बनाए हैं ताकि कोई भी छात्र इसे आसानी से समझ सके। हिंदी में यह समाधान सभी छात्रों के लिए बहुत मददगार होने वाला है। हमने सभी विषयों के एनसीईआरटी कक्षा 12 के नोट्स भी बहुत ही सरल तरीकों से हिंदी में बनाए हैं।
प्रश्न 1.
संक्रमण तत्त्व क्या हैं? इनकी विशेषताओं को लिखिए।
या
संक्रमण तत्त्वों के अनुचुम्बकीय लक्षण को स्पष्ट कीजिए।
उत्तर
वे तत्त्व जिनमें अन्तिम इलेक्ट्रॉन बाह्य कोश से पहले वाले कोश के पाँच d-कक्षकों में से किसी भी एक कक्ष में प्रवेश करता है, d-ब्लॉक के तत्त्व कहलाते हैं। इनमें विभेदी इलेक्ट्रॉन (n-1) d-कक्षकों में प्रवेश पाता है। चूँकि इन तत्त्वों के गुण s-ब्लॉक तथा p-ब्लॉक के तत्त्वों के गुणों के मध्यवर्ती होते हैं अत: इन्हें संक्रमण तत्त्व भी कहते हैं।
विशेषताएँ– संक्रमण तत्त्वों की विशेषताएँ निम्नलिखित हैं –
1. इलेक्ट्रॉनिक विन्यास – संक्रमण तत्त्वों में बाह्यकोश से पिछले कोश के d ऑर्बिटलों में इलेक्ट्रॉन भरते हैं। इसके बाह्यतम दो कोशों का विन्यास इस प्रकार होता है –
(n – 1)s2 (n – 1)p6 (n-1)d1 to 10 ns1 or 2 या ns0
- परिवर्ती ऑक्सीकरण अवस्थाएँ– d-ब्लॉक (संक्रमण) तत्त्वों में ns ऑर्बिटल और (n – 1)d ऑर्बिटल दोनों के इलेक्ट्रॉन रासायनिक बन्ध बनाने में भाग लेते हैं। इसलिए संक्रमण तत्त्व परिवर्ती ऑक्सीकरण अवस्था प्रदर्शित करते हैं।
संक्रमण तत्त्वों में (n – 1)d और ns ऊर्जा स्तरों की ऊर्जा में थोड़ा अन्तर होने के कारण ये इलेक्ट्रॉन रासायनिक बन्ध बनाने में भाग ले सकते हैं। इसलिए संक्रमण तत्त्व परिवर्ती ऑक्सीकरण संख्या प्रदर्शित करते हैं। - उत्प्रेरक गुण– संक्रमण धातु और उनके यौगिकों में उत्प्रेरकीय गुण होते हैं। यह गुण उनकी परिवर्ती संयोजकता एवं उनके पृष्ठ पर उपस्थित मुक्त संयोजकताओं के कारण होता है।
- रंगीन आयन व रंगीन यौगिक बनाने की प्रवृत्ति– संक्रमण तत्त्वों में d ऑर्बिटल आंशिक रूप से भरे होने के कारण ये रंगीन आयन व रंगीन यौगिक बनाते हैं।
- आयनन विभव में परिवर्तन– संक्रमण धातुओं के प्रथम आयनन विभव दीर्घ आवर्गों में स्थित s-ब्लॉक और p ब्लॉक तत्त्वों के आयनन विभवों के बीच के हैं। प्रथम संक्रमण श्रेणी में तत्त्वों के प्रथम आयनन विभवों के मान 6 से 10 eV के मध्य है। किसी संक्रमण धातु परमाणु के उत्तरोत्तर (successive) आयनन विभव कम से बढ़ते हैं। संक्रमण धातु क्षार धातुओं (उपवर्ग IA) और क्षारीय मृदा-धातुओं (उपवर्ग IIA) से कम धन विद्युत होने के कारण आयनिक और सहसंयोजक दोनों प्रकार के यौगिक बनाते हैं।
- चुम्बकीय लक्षण– अनेक संक्रमण तत्त्व उनके यौगिक अनुचुम्बकीय हैं। इसका कारण उनमें (n – 1) d कक्षकों में अयुग्मित इलेक्ट्रॉनों की उपस्थिति है। किसी संक्रमण श्रेणी में बायें से दायें जाने पर जैसे-जैसे अयुग्मि इलेक्ट्रॉनों की संख्या एक से पाँच तक बढ़ती है, संक्रमण धातु आयन में अनुचुम्बकीय लक्षण बढ़ता है। अधिकतम अनुचुम्बकीय लक्षण श्रेणी के बीच में पाया जाता है और आगे जाने पर अनुचुम्बकीय लक्षण अयुग्मित इलेक्ट्रॉनों की संख्या कम होने से घटता है। वे संक्रमण धातु अथवा आयन जिनमें इलेक्ट्रॉन युग्मित होते हैं, प्रतिचुम्बकीय होते हैं।
प्रश्न 2.
संक्रमण तत्त्व परिवर्ती ऑक्सीकरण अवस्था का प्रदर्शन क्यों करते हैं?
उत्तर
संक्रमण तत्त्वों का सामान्य इलेक्ट्रॉनिक विन्यास (n – 1)d1 – 10 ns1 – 2 है। (n – 1) d-कक्षकों तथा ns- कक्षकों की ऊर्जाओं में अधिक अन्तर नहीं होता है अत: संक्रमण तत्त्वों में, (n – 1)d तथा ns दोनों कक्षकों के आबन्ध निर्माण के लिए उपलब्ध रहती हैं। +1 तथा +2 ऑक्सीकरण अवस्थाओं में ns-इलेक्ट्रॉनों का योगदान होता है, जबकि उच्च ऑक्सीकरण अवस्थाओं जैसे +3, +4,+ 5,+6 आदि, में आबन्ध निर्माण में ns-कक्षकों के साथ (n – 1)d-इलेक्ट्रॉनों का भी योगदान होता है। उत्तेजित अवस्था में (n – 1) d. इलेक्ट्रॉन आबन्ध निर्माण में भाग लेने के लिए स्वतन्त्र हो जाते हैं तथा परमाणु विभिन्न ऑक्सीकरण अवस्थाएँ प्रदर्शित करने के योग्य हो जाता है। उदाहरण के लिए, Sc का बाह्य इलेक्ट्रॉनिक विन्यास 3d1 4s2 है। जब यह केवल 4s-इलेक्ट्रॉनों का उपयोग करता है तो +2 ऑक्सीकरण अवस्था प्रदर्शित करता है, परन्तु जब यह दोनों 4s- इलेक्ट्रॉनों के साथ एक 3d-इलेक्ट्रॉन का भी उपयोग करता है तो +3 ऑक्सीकरण अवस्था प्रदर्शित करता है।
प्रश्न 3.
संक्रमण तत्त्वों में जटिल यौगिक बनाने की प्रवृत्ति अधिक क्यों होती है?
उत्तर
संक्रमण तत्त्वों में जटिल यौगिक बनाने की प्रवृत्ति निम्नलिखित कारणों से अधिक होती है –
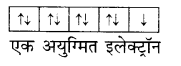
- धातु आयनों का छोटा आकार
- धातु आयनों का उच्च नाभिकीय आवेश
- लीगैण्ड द्वारा प्रदान किये गये इलेक्ट्रॉनों के एकाकी युग्मों को ग्रहण करने के लिए उपयुक्त ऊर्जा के रिक्त d-कक्षकों की प्राप्यता।
प्रश्न 4.
ऐक्टिनाइड्स व लैन्थेनाइड्स में मुख्य समानताएँ बताइए।
उत्तर
चूंकि लैन्थेनाइड्स तथा ऐक्टिनाइड्स दोनों में ही इलेक्ट्रॉन (n- 2) f-उपकोश में प्रवेश पाता है। तथा दोनों के ही बाह्य इलेक्ट्रॉनिक विन्यास लगभग समान हैं, अतः ये गुणों में समानताएँ प्रदर्शित करते हैं। इनकी मुख्य समानताएँ निम्नलिखित हैं –
- दोनों में ही (n – 2) f- कक्षक में इलेक्ट्रॉन प्रवेश करता है।
- दोनों की प्रमुख ऑक्सीकरण अवस्था +3 है।
- परमाणु क्रमांक बढ़ने पर दोनों ही परमाणविक तथा आयनिक आकारों में कमी प्रदर्शित करते हैं (लैन्थेनाइड संकुचन तथा ऐक्टिनाइड संकुचन)।
- दोनों ही अधिक क्रियाशील तथा प्रबल विद्युत धनात्मक हैं।
- दोनों ही चुम्बकीय गुण प्रदर्शित करते हैं।

प्रश्न 5.
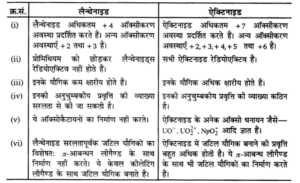
लैन्थेनाइड्स व ऐक्टिनाइड्स में अन्तर/ असमानताएँ बताइए।
उत्तर
लैन्थेनाइड्स व ऐक्टिनाइड्स में निम्नलिखित अन्तर/असमानताएँ हैं –
प्रश्न 6.
ऐक्टिनाइड्स क्या हैं? इन्हें ऐक्टिनाइड्स क्यों कहा जाता है? इनके प्रमुख उपयोग लिखिए।
उत्तर
आन्तरिक संक्रमण तत्त्व अथवा f-ब्लॉक तत्त्वों की दो श्रेणियाँ होती हैं –
- लैन्थेनाइड श्रेणी तथा
- ऐक्टिनाइड श्रेणी।
ऐक्टिनाइड श्रेणी में थोरियम से लेकर लॉरेन्शियम तक के चौदह तत्त्वों को ऐक्टिनाइड्स कहा जाता है। ये तत्त्व आवर्त सारणी में ऐक्टिनियम का अनुसरण करते हैं तथा भौतिक व रासायनिक गुणों में उससे समानता भी प्रकट करते हैं। इसलिए इन्हें ऐक्टिनाइड्स कहा जाता है।
ऐक्टिनाइडों के उपयोग
- यूरेनियम तथा प्लूटोनियम का मुख्य उपयोग नाभिकीय रिएक्टर से परमाणु ऊर्जा उत्पादन में ईंधन के रूप में किया जाता है। प्लूटोनियम का उपयोग परमाणु हथियार बनाने में भी किया जाता है।
- थोरियम ऑक्साइड का उपयोग चमकने वाले गैस मेन्टल के निर्माण में होता है।
- यूरेनियम के लवणों का उपयोग हरे रंग के काँच के निर्माण में होता है।
- थोरियम लवण का उपयोग आजकल कैंसर के उपचार में होता है।
दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
संक्रमण तत्त्वों को वर्गीकृत कीजिए तथा आवर्त सारणी में इनका स्थान निर्धारित कीजिए।
उत्तर
संक्रमण तत्त्वों का वर्गीकरण – संक्रमण तत्त्वों का वर्गीकरण (n – 1)d- कक्षकों के आधार पर किया गया है। इस आधार पर संक्रमण तत्त्वों को चार श्रेणियों में विभाजित किया गया है जिन्हें संक्रमण श्रेणियाँ (transition series) कहते हैं। प्रत्येक श्रेणी (n – 1)d- कक्षक में इलेक्ट्रॉन-प्रवेश के क्रम के अनुसार है। ये संक्रमण श्रेणियाँ निम्नलिखित हैं –
- प्रथम संक्रमण श्रेणी अथवा 3d- श्रेणी– इस श्रेणी में इलेक्ट्रॉन 3d- कक्षक में प्रवेश पाता है। इस श्रेणी में Sc (Z = 21) से Zn (Z = 30) तक 10 तत्त्व हैं। ये तत्त्व आवर्त सारणी के चतुर्थ आवर्त में स्थित हैं।
- द्वितीय संक्रमण श्रेणी अथवा 4d- श्रेणी– इस श्रेणी में इलेक्ट्रॉन 4d- कक्षक में प्रवेश पाता है। इस श्रेणी में 10 तत्त्व Y(Z = 39) से Cd (Z = 48) हैं। ये तत्त्व आवर्त सारणी के पाँचवे आवर्त में स्थित हैं।
- तृतीय संक्रमण श्रेणी अथवा 5d- श्रेणी– इस श्रेणी में इलेक्ट्रॉन 5d-कक्षक में प्रवेश पाता है। इस श्रेणी में 10 तत्त्व La (Z = 57) तथा Hf (Z = 72) से Hg (Z = 80) हैं। ये तत्त्व आवर्त सारणी के छठे आवर्त में स्थित हैं।
- चतुर्थ संक्रमण श्रेणी अथवा 6d- श्रेणी– इस श्रेणी में इलेक्ट्रॉन 6d-कक्षक में प्रवेश पाता है। इस श्रेणी में 10 तत्त्व Ac (Z = 89) तथा Rf (Z = 104) से कॉपरनिसियम (Z = 112) हैं। ये तत्त्व आवर्त सारणी के सातवें आवर्त में स्थित हैं।
आवर्त सारणी में स्थिति – आवर्त सारणी में संक्रमण तत्त्व (d.ब्लॉक तत्त्व) समूह 2 तथा समूह 13 के मध्य स्थित हैं। d-ब्लॉक तत्त्व s-ब्लॉक तथा p-ब्लॉकों के मध्य स्थित हैं। d-ब्लॉक तत्वों को संक्रमण’ की संज्ञा इसी कारण ही प्रदान की गई है। s-ब्लॉक के तत्त्व अत्यधिक विद्युत धनात्मक होते हैं तथा आयनिक यौगिकों के निर्माण की प्रवृत्ति प्रदर्शित करते हैं। इसके विपरीत p-ब्लॉक के तत्त्व विद्युत ऋणात्मक होते हैं। और इनमें सहसंयोजी यौगिकों को बनाने की प्रवृत्ति होती है। d-ब्लॉक तत्त्व इन दोनों के मध्य एक संक्रमण व्यवहार प्रदर्शित करते हैं अर्थात् उनका व्यवहार अत्यधिक विद्युत धनात्मक s-ब्लॉक तत्त्वों तथा अत्यन्त दुर्बल रूप से विद्युत धनात्मक p-ब्लॉक तत्त्वों के मध्य का होता है। इस कारण ही d-ब्लॉक तत्त्वों को संक्रमण तत्त्व (transition elements) कहा जाता है।